

 |
 |
Πως αποδεικνύεται ότι το μοντελο Bohr είναι ανακριβές;Συχνές ερωτήσεις, Νοέμβριος 2001 |
|
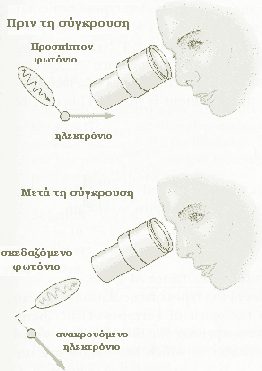 |
Ένα πρόβλημα όμως εμφανίζεται εδώ, καθώς το φωτόνιο μεταφέρει κάποιο άγνωστο ποσό ορμής του στο ηλεκτρόνιο. Κατά συνέπεια, στο στάδιο της εύρεσης μια ακριβούς θέσης του ηλεκτρονίου (κάνοντας το Δx πραγματικά μικρό), το ίδιο φως που επιτρέπει σε εσάς να το δείτε αυτό, αλλάζει την ορμή του ηλεκτρονίου σε μια απροσδιόριστη έκταση, κάνοντας το Δp πολύ μεγάλο.
Αν χρησιμοποιήσουμε φωτόνιο χαμηλής συχνότητας, το μήκος κύματος του θα περιορίσει την ακρίβεια με την οποία θα εντοπίσουμε το ηλεκτρόνιο. Από την άλλη μεριά ένα φωτόνιο μικρού μήκους κύματος δίνει καθαρότερη εικόνα αλλά θα προκαλέσει μια διατάραξη στην ορμή του ηλεκτρονίου, αφού έχει μεγάλη συχνότητα άρα και μεγάλη ορμή.
Τα δύο είδη λοιπόν φωτονίων δίνουν αμοιβαίως αποκλειόμενα αποτελέσματα. Υπάρχει λοιπόν καθορισμένο όριο στην ακρίβεια της γνώσης μας για τις υποατομικές καταστάσεις.
Με βάση την αρχή της αβεβαιότητας, ο Heisenberg απέδειξε ότι το μοντέλο Bohr του ατόμου είναι ανακριβές.
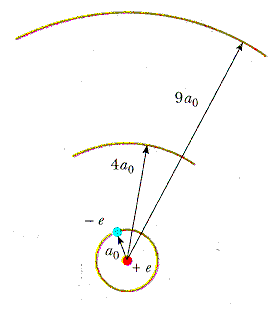 |
Το μοντέλο του Bohr του ατόμου υδρογόνου υποθέτει
ότι το ηλεκτρόνιο στην βασική του κατάσταση,
κινείται σε μια κυκλική τροχιά ακτίνας R=0.529*10-10
m, και η ταχύτητα του ηλεκτρονίου σε αυτή τη
κατάσταση είναι 2.2*106 m/s.
Λαμβάνοντας υπόψη την ακριβή ακτίνα, η αβεβαιότητα Δr σε αυτό το μοντέλο είναι μηδέν. Σύμφωνα με την αρχή της αβεβαιότητας, το γινόμενο Δp.Δr > = h/2, όπου Δp είναι η αβεβαιότητα στην ορμή του ηλεκτρονίου στην διεύθυνση της ακτίνας.
Επειδή η ορμή του ηλεκτρονίου είναι m v, μπορούμε να υποθέσουμε ότι η αβεβαιότητα στην ορμή της είναι λιγότερη από αυτή τη τιμή. Δηλαδή η Δp είναι μικρότερη από m v = 9,11*10-31 x 2,2*106 m/s) = 2,0 * 10 -24 kg*m/s.
Από την αρχή αβεβαιότητας, η κατ' εκτίμηση ελάχιστη αβεβαιότητα στην ακτινωτή θέση θα ήταν: = x/(2Δp) = 0.26*10 10 m.
Δηλαδή η αβεβαιότητα στη θέση αυτή είναι κοντά στο μέγεθος της ακτίνας Bohr, και κατά συνέπεια αποδεικνύεται πως το μοντέλο Bohr είναι ανακριβές, εφόσον η αβεβαιότητα για την ακτίνα φθάνει στο ίδιο μέγεθος που μας δίνει το μοντέλο του Bohr.
| Ενδιαφέρουσες ιστοσελίδες |
| Κβαντικη απροσδιοριστία |
| Η σελίδα της Αρχής της Απροσδιοριστίας |