

 |
 |
Ειδικές θερμότητες στερεών σωμάτων και η συμβολή του Einstein στην κατανόησή τους.Άρθρο, Ιανουάριος 2003 |
|
Η ειδική θερμότητα είναι το ποσόν της θερμότητας ανά μονάδα μάζας, το οποίον απαιτείται για να ανυψωθεί η θερμοκρασία της μάζας κατά ένα βαθμό Κελσίου ή Kelvin. Η σχέση μεταξύ της θερμότητας και της μεταβολής της θερμοκρασίας, εκφράζεται συνήθως με την παρακάτω μορφή, όπου Q είναι η ποσότητα θερμότητας που προσφέρεται η αφαιρείται από ένα σώμα μάζας m, το c είναι η ειδική θερμότητα του σώματος, και το ΔΤ είναι η μεταβολή στη θερμοκρασία του. Η σχέση όμως αυτή δεν εφαρμόζεται όταν συμβαίνει μια αλλαγή φάσης, διότι η θερμότητα που προστίθεται ή αφαιρείται από από μια μάζα κατά την αλλαγή φάσης της, δεν μεταβάλλει τη θερμοκρασία. Οι ειδικές θερμότητες των περισσότερων στερεών σωμάτων στη θερμοκρασία δωματίου και υψηλότερα είναι σχεδόν σταθερές. σε συμφωνία με τον νόμο των Dulong and Petit. Σε χαμηλότερες θερμοκρασίες, οι ειδικές θερμότητες μειώνονται καθώς υπεισέρχονται διάφορες κβαντικές διαδικασίες. Η συμπεριφορά των ειδικών θερμοτήτων σε χαμηλές θερμοκρασίες περιγράφεται από το μοντέλο των Einstein και Debye. Ο νόμος των Dulong και PetitΗ ειδική θερμότητα του χαλκού
είναι 0.093 cal/gm C (ή 0.389 J/gm C) και αυτή του
μολύβδου είναι μόνον Το θεώρημα ισοκατανομής της ενέργειας μας λέει ότι η μέση τιμή ενέργειας που αντιστοιχεί σε κάθε θερμοδυναμικό βαθμό ελευθερίας ενός ατόμου, είναι kT/2, όπου k η σταθερά του Boltzmann, και Τ η θερμοκρασία των ατόμων του συστήματος που μελετάμε. Έτσι αν τα άτομα έχουν μόνο τη δυνατότητα της ελεύθερης μεταφορικής κίνησής τους στο χώρο (κατά τους 3 άξονες του χώρου), λέμε ότι έχουν 3 βαθμούς ελευθερίας και η μέση ενέργεια κάθε ατόμου θα είναι: 3kT/2 Τα άτομα όμως ενός στερεού σώματος μπορούν να εκτελούν και ταλαντώσεις και αυτές συνεισφέρουν ακόμη 3 βαθμούς ελευθερίας για τα άτομα των στερεών σωμάτων. Έτσι η ολική ενέργεια ανά άτομο για ένα στερεό σώμα γίνεται: 3kT. Η ειδική θερμότητα υπό σταθερό όγκο θα είναι ακριβώς ο ρυθμός της μεταβολής αυτής της ενέργειας, ΝΑ ατόμων που αντιστοιχούν σε ένα mole, με τη θερμοκρασία. Η παράγωγος δηλαδή της συνολικής ενέργειας ΝΑ ατόμων με τη θερμοκρασία.
Ο νόμος των Dulong και Petit, προβλέπει τότε θεωρητικά ότι: 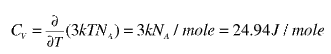 Αν κοιτάξουμε τις πειραματικές
τιμές αναφερόμενες ανά mole, για τον
χαλκό και τον μόλυβδο, παρατηρούμε ότι
είναι αρκετά όμοιες: Αποκλίσεις από τον νόμο των Dulong και PetitΟι πειραματικές καμπύλες των
ειδικών θερμοτήτων διαφέρουν στις
χαμηλές θερμοκρασίες από τις
προβλέψεις του νόμου των Dulong και Petit.
Στα παρακάτω σχήματα εικονίζονται οι
αντίστοιχες καμπύλες για το πυρίτιο
και τον χαλκό. Παρατηρούμε ότι μόνο
στις σχετικά υψηλές θερμοκρασίες, οι
καμπύλες αυτές τείνουν στις σταθερές
τιμές που προβλέπει ο νόμος αυτός. Στις
χαμηλές θερμοκρασίες, το πυρίτιο
ακολουθεί μια συμπεριφορά ανάλογη του
Τ3 πράγμα που όπως θα δούμε
προβλέπει το μοντέλο του Debye. Ο χαλκός
όμως, σε ενδιάμεσες θερμοκρασίες
ακολουθεί το μοντέλο του Debye, ενώ στις
πολύ χαμηλές θερμοκρασίες διαφέρει και
από το μοντέλο του Debye, επειδή στην
ειδική θερμότητα έχουν πια συνεισφορά
και τα ηλεκτρόνια. 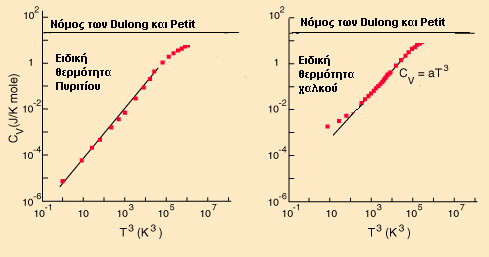 Η συνεισφορά του Einstein στη θεωρία των ειδικών θερμοτήτων Η εξήγηση της δραστικής απόκλισης από το νόμο των Dulong και Petit ήταν μια μεγάλη συνεισφορά από τους Einstein και Debye. Ο νόμος των Dulong και Petit προϋπέθετε ότι η στατιστική Maxwell-Boltzmann, και η ισοκατανομή της ενέργειας ίσχυαν ακόμη και σε χαμηλές θερμοκρασίες. Ο Einstein αναγνώρισε ότι για κβαντικούς αρμονικούς ταλαντωτές, σε ενέργειες μικρότερες από kT, έπρεπε να εφαρμοστεί η στατιστική Bose-Einstein. Αυτό βασικά ήταν το ίδιο συμπέρασμα με εκείνο που είχαν καταλήξει κατά τη μελέτη της ακτινοβολίας του μέλανος σώματος. Η στατιστική κατανομή στις ενεργειακές στάθμες των ταλαντωτών δίνει ως μέση ενέργεια την παρακάτω: όπου ν η συχνότητα του κβαντικού ταλαντωτή. Επειδή υπάρχουν τρεις βαθμοί ελευθερίας ανά ταλαντωτή, η ολική ενέργεια ανά mole είναι: 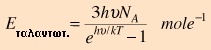 Η παράγωγος της τελευταίας ως προς την θερμοκρασία δίνει: 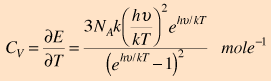 Μπορεί ν' αποδειχτεί ότι στις
υψηλές θερμοκρασίες, η σχέση αυτή έχει
ως όριο τη σταθερή τιμή του νόμου Dulong
και Petit. Η έκφραση του Einstein για την ειδική θερμότητα γίνεται τότε: 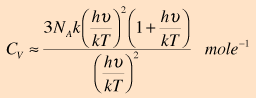 Η τελευταία σχέση ανάγεται στο νόμο των Dulong και Petit αν το Τ τείνει στο άπειρο. 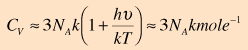 Στην προσέγγιση του Einstein, η κατάλληλη συχνότητα του ταλαντωτή στις παραπάνω εκφράσεις, έπρεπε ν' αποφασιστεί εμπειρικά κατόπιν σύγκρισης με το πείραμα, για κάθε στοιχείο ξεχωριστά. Η ποσότητα hν/k μερικές φορές λέγεται και θερμοκρασία Einstein. Αν και γενικά υπάρχει μια καλή συμφωνία των παραπάνω σχέσεων με το πείραμα, εντούτοις, η συμφωνία αυτή δεν είναι απολύτως ακριβής. Ο Debye προχώρησε το μοντέλο, αντιμετωπίζοντας τους κβαντικούς ταλαντωτές ως συλλογικές διεγέρσεις σε όλο το στερεό, τις οποίες σήμερα αποκαλούμε "φωνόνια". |
||
|